1.
Asam basa
Bronsted-Lowry.
Menurut
bronsted-lowry, asam adalah senyawa yang dapat menyumbangkan proton (H+),
sedangkan basa adalah senyawa yang dapat menerima proton.
2.
Asam basa Lewis
Menurut
lewis, asam adalah senyawa yang dapat menerima pasangan elektron bebas (PEB),
sedangkan basa adalah senyawa yang dapat mendonorkan pasangan elektron bebas
(PEB). Syarat bagi basa lewis yaitu harus mempunyai PEB, sedangkan bagi asam
lewis harus memiliki orbital yang kosong untuk menerima PEB.
Atom
C pusat yang kekurangan elektron bertindak sebagai asam lewis atau disebut
dengan elektrofil. Elektrofil ini dapat stabil jika orbital yang kosong sudah
terisi. Sedangkan basa lewis disebut juga sebagai nukleofil yang akan mencari
atom bermuatan positif yang kekurangan elektron.
3.
Kekuatan asam
basa
Untuk
melihat kekuatan asam dan basa suatu spesi dapat ditinjau berdasarkan nilai
tetapan ionisasi asam (Ka) dan tetapan ionisasi basa (Kb)
pada teori bronsted-lowry. Semakin besar nilai Ka maka semakin
banyak asam yang terurai sehingga nilai konsentrasi asam juga semakin besar.
Begitu juga dengan nilai Kb yaitu semakin besar Kb maka
semakin kuat kebasaannya.
Untuk
memprediksi kekuatan asam dan basa dapat kita lihat berdasarkan struktur
molekul suatu senyawa, mengamati pola keelektronegatifan atom pusat dan atom
luar, dan memahami struktur lewisnya.
a.
Efek kekuatan
ikatan
Pada
golongan halida, semakin tidak efektiforbital yang tumpang tindih antara
orbital 1s hidrogen dengan orbital unsur-unsur yang lebih besar, maka semakin
lemah ikatan antara atom H dengan halogen, semakin mudah lepas ikatan H dengan
halogen dan semakin kuat asam halida tersebut.
b.
Efek
kelektronegatifan.
Pada
tabel periodik unsur, dari kiri ke kanan keasaman unsur akan meningkat. Adapun
faktor yang mempengaruhi keasaman adalah elektronegativitas atom yang terikat
pada hidrogen. Pengaruh keelektronegarifan atom terhadap kekuatan asam ada 2,
yaitu pengaruh polaritas ikatan ke proton dan pengaruh stabilitas relatif anion
(basis konjugat) yang terbentuk ketika proton hilang. Pada golongan halida,
yangpaling elektronegatif adalah F, sehingga ikatan H-F paling mudah
terpolarisasi dan proton HF bersifat positif. Maka HF akan sangat mudah
kehilangan proton sehingga bersifat paling
asam.
Semakin
kuat sifat asamnya, maka semakin lemah anion yang dihasilkan. Anion yang
bersifat basa kuat relatif tidak stabil.
c.
Efek hibridisasi
Pada
umumnya atom pusat yang memiliki hibridisasi sp bersifat lebih asam
dibandingkan sp2 dan sp3. Karakter s yang besar akan
membuatnya bersifat lebih elektronegatif dari yang lain.
Keasaman:
CH≡CH ˃ CH2=CH2 ˃ CH3-CH3
Kebasaan
dari anion: CH≡C:- ˂ CH2=CH:- ˂ CH3-CH2:_
d.
Efek induktif
Efek
induktif merupakan efek elektronik yang ditransmisikan melalui ikatan pada
gugus yang berupa dorongan elektron atau penarikan elektron. Efek induktif akan
lemah jika jarak dari kelompok meningkat.
e.
Pengaruh pelarut
Solvasi
(hidrasi) oleh molekul pelarut terhadap anion dan kation terlarut akan mudah
membentuk ion hidronium sehingga dapat memberikan sifat asam.
Contoh:
asam karboksilat sederhana, adanya gugus metil akan meyebabkan induksi positif sehingga menghambat pelesan proton.
asam karboksilat sederhana, adanya gugus metil akan meyebabkan induksi positif sehingga menghambat pelesan proton.
4.
Kestabilan
asam/basa konjugat.
Jika asamnya merupakan asam kuat, maka akan menghasilkan basa lemah yangbersifat
stabil dan merupakan gugus pergi yang baik. Dan sebaliknya, jika asamnya
merupakan asam lemah maka akan menghasilkan basa konjugat kuat yang bersifat
tidak stabil dan merupakan gugus pergi yang sulit lepas. Adapun faktor penentu
kestabilan baja konjugat sebagai berikut:
a.
Jika muatannya
semakin tinggi maka semakin tidak stabil
b.
Jika
keelektronegatifan semakin tinggi maka akan semakin stabil
c.
Untuk golongan
dari atas ke bawah, jika polarisasi semakin besarmaka maka akan semakin stabil
pada spesi yang bermuatan negatif.
d.
Semakin banyak
jumlah struktur, maka resonansinya akan semakin stabil
e.
Efek induksi
pada gugus penarik elektron dapat menstabilkan basa konjugat, sehingga semakin
banyak gugus penarik elektron maka semakin stabil
f.
Orbital hibrida
sp lebih stabil dibandingkan sp2dan sp3.
5.
Reaksi kimia
organik berdasarkan reaksi asam basa
Reaksi
transfer proton merupakan langkah awal dalam reaksi alkohol, eter, aldehid,
keton, ester, amida, dan asam karboksilat. Contoh: reaksi alkilasi friedel
crafts
R-Cl
+ AlCl3 → R+ + AlCl4-
Asam
karboksilat (asam alkanoat) merupakan asam organik alifatik yang mempunyai
gugus karboksil (-COOH) yang termasuk asam lemah (dalam larutan hanya
terdisosiasi sebagian menjadi kation H+ dan anion RCOO- ),
semakin panjang rantai karbon maka semakin lemah keasamannya. Didalam air
molekulnya akan terionisasi dengan melepaskan atom hidrogen menjadi ion H+.
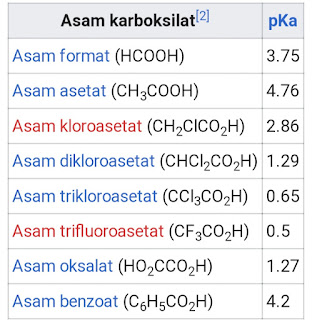
Contoh asam karboksilat beserta nilai pKa sebagai berikut:
Manfaat
asam karboksilat:
1.
Asam formiat (CH2O2)
Berdasarkan
strukturnya, asam formiat bersifat asam lemah, sehingga asam formiat dalam
jumlah yang sedikit terdapat dalam keringat, keringat akan berbau asam,
digunakan dalam industri tekstil, Jika terkena kulit dapat membuatnya lepuh,
serta dapat mereduksi senyawa lain.
Larutan
cuka digunakan dalam makanan merupakan 25% dari volume asam asetat, sedangkan
asam asetat murni disebut asam asetat glasial.
Berdasarkan
struktur molekulnya, rantai karbon asam glutamat lebih panjang dibandingkan
asam formiat dan asam asetat sehingga sifat asamnya akan lebih lemah. Oleh
karena itu, dalam bentuk monosodium glutamat (MSG) digunakan sebagai penyedap
rasa.
Berdasarkan
strukturnya, asam oksalat bersifat asam lemah, terhidrolisis sebagian dalam
air, sehingga ssam oksalat biasanya digunakan sebagai pelarut produk perawatan
kebersihan pada wanita, sebagai pelarut senyawa organik, sebagai bahan aditif
pada makanan, dan campuran produk pembersih seperti detergent.
5. Asam benzoat (C6H5COOH)
5. Asam benzoat (C6H5COOH)
Asam benzoat meruapak jenis pengawet yang digunakan pada saos dan sambal. Asam benzoat berperan untuk mencegah ragi, khamir dan bakteri pada makanan kemasan yang sudah dibuka pada pH 2,5-4. Asam benzoat dapat ditemukan pada cengkeh dan kayu manis. Cara kerja asam benzoat sebagai pengawet yaitu dengan menghambat, mencegah dan menghentikan proses pembusukan serta fermentasi pada bahan makanan. Mekanisme kerjanya berdasarkan pada tngkatan permeabilitas membran sel mikroba terhadap molekul asam. Dimana asam benzoat ini dapat menembus membran sel mikroba yang memiliki pH netral, sehingga dapat menaikkan pH didalam sel mikroba menjadi lebih asam. Kondisi asam inilah yang dapat mengganggu metabolisme organ-organ sel sehingga menyebabkan selnya mati.
Permasalahan:
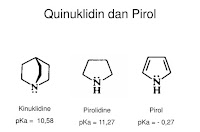
- Berdasarkan Struktur Kinuklidin, pirolidine, dan pirol. Mengapa pirolidine dapat memiliki pKa yang paling besar diantara ketiga senyawa tersebut?
- Asam maleat dan asam fumarat mempunyai rumus molekul sama yaitu C4H4O4, dimana pada struktur asam maleat memiliki posisi cis pada ikatan hidrogennya, sedangkan pada asam fumarat membentuk posisi trans pada ikatan hidrogennya. Asam maleat bersifat lebih asam dibandingkan asam fumarat. Bagaimana pengaruh dari posisi cis dan trans ini terhadap sifat keasaman kedua senyawa tersebut?
- Bagaimana pengaruh efek
induksi pada asam oksalat terhadap potensi pemanfaatannya sebagai campuran
produk pembersih detergent?